Friday, 16 October 2020
บทที่3.5
บทที่3.4
พันธะโลหะ (Metallic bonding) เป็นพันธะภายในโลหะซึ่งเกี่ยวข้องกับ การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่างแลตทิซของอะตอมโลหะดังนั้นพันธะโลหะจึงอาจเปรียบได้กับเกลือที่หลอมเหลวอะตอมของโลหะมีอิเล็กตรอนพิเศษเฉพาะในวงโคจรชั้นนอกของมันเทียบกับคาบ(period)หรือระดับพลังงานของพวกมัน อิเล็กตรอนที่เคลื่อนย้ายเหล่านี้ เปรียบได้กับทะเลอิเล็กตรอน(Sea of Electrons) ล้อมรอบแลตทิชขนาดใหญ่ของไอออนบวกพันธะโลหะเทียบได้กับพันธะโควาเลนต์ที่เป็น นอน-โพลาร์ ที่จะไม่มีในธาตุโลหะบริสุทธ์ หรือมีน้อยมากในโลหะผสม ความแตกต่าง อิเล็กโตรเนกาทิวิตีระหว่างอะตอม ซึ่งมีส่วนในปฏิกิริยาพันธะ และอิเล็กตรอนที่เกี่ยวข้องในปฏิกิริยาจะเคลื่อนย้ายข้ามระหว่างโครงสร้างผลึกของโลหะ พันธะโลหะเขียนสูตรทางเคมีไม่ได้ เพราะไม่ทราบจำนวนอะตอมที่แท้จริง อาจจะมีเป็นล้านๆ อะตอมก็ได้
บทที่3.3
พันธะโคเวเลนต์(Covalent bond) มาจากคำว่า co + valence electron ซึ่งหมายถึง พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน ดังเช่น ในกรณีของไฮโดรเจน ดังนั้นลักษณะที่สำคัญของ พันธะโคเวเลนต์ก็คือการที่อะตอมใช้เวเลนต์อิเล็กตรอนร่วมกันเป็นคู่ ๆ
-สารประกอบที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เรียกว่าสารโคเวเลนต์
-โมเลกุลของสารที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์เรียกว่าโมเลกุลโคเวเลนต์
1. การเกิดพันธะโคเวเลนต์ เนื่องจาก พันธะโคเวเลนต์ เกิดจากการใช้เวเลนต์อิเล็กตรอนร่วมกัน ซึ่งอาจจะใช้ร่วมกันเพียง 1 คู่ หรือมากกว่า 1 คู่ก็ได้
- อิเล็กตรอนคู่ที่อะตอมทั้งสองใช้ร่วมกันเรียกว่า “อิเล็กตรอนคู่ร่วมพันธะ”
- อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่าอะตอมคู่ร่วมพันธะ * ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 1 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะเดี่ยว เช่น ในโมเลกุลของไฮโดรเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะคู่ เช่น ในโมเลกุลของออกซิเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะสาม เช่น ในโมเลกุลของไฮโดรเจน
จากการศึกษาสารโคเวเลนต์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่นBe เกิดเป็นสารโคเวเลนต์คือ BeCl2เป็นต้น
สารประกอบโคเวเลนต์ มีสมบัติดังนี้ |
1. มีสถานะเป็นของแข็ง ของเหลว หรือแก๊ส เช่น |
-สถานะของเหลว เช่น น้ำเอทานอลเฮกเซน |
-สถานะของแข็ง เช่น น้ำตาลทราย (C12H22O11),แนพทาลีนหรือลูกเหม็น (C10H8) |
-สถานะแก๊ส เช่น แก๊สคาร์บอนไดออกไซด์ (CO2),แก๊สมีเทน (CH4),แก๊สโพรเพน (C3H8) |
2. มีจุดหลอมเหลวต่ำ หลอมเหลวง่ายเนื่องจากมีแรงยึดเหนี่ยวระหว่างโมเลกุลที่ไม่แข็งแรงสามารถถูกทำลายได้ง่าย |
3. มีทั้งละลายน้ำและไม่ละลายน้ำ เช่น เอทานอลละลายน้ำ แต่เฮกเซนไม่ละลายน้ำ |
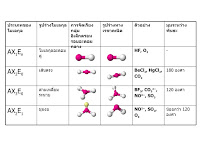
4.สารประกอบโคเวเลนต์ไม่นำไฟฟ้าเนื่องจากมีประจุไฟฟ้าเป็นกลาง และอิเล็กตรอนทั้งหมดถูกใช้เป็นอิเล็กตรอน การเรียกชื่อสารประกอบโคเวเลนต์ สารประกอบโคเวเลนต์เป็นโมเลกุลของสารที่เกิดจากอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมาสร้างพันธะโคเวเลนต์ต่อกันด้วยสัดส่วนต่าง ๆ กัน ทำให้เป็นการยากในการเรียกชื่อสาร จึงได้มีการตั้งกฎเกณฑ์ในการเรียกชื่อสารประกอบโคเวเลนต์ขึ้น เพื่อให้สามารถสื่อความเข้าใจถึงลักษณะโครงสร้างของสารประกอบโคเวเลนต์ได้ตรงกัน โดยนักวิทยาศาสตร์ได้กำหนดหลักเกณฑ์ในการเรียกชื่อสารประกอบโคเวเลนต์ไว้ดังนี้ 1.ให้เรียกชื่อของธาตุที่อยู่ข้างหน้าก่อนแล้วตามด้วยชื่อของธาตุที่อยู่ด้านหลัง โดยเปลี่ยนเสียงพยางค์ท้ายของธาตุเป็น-ไอด์(-ide) ดังตัวอย่างดังต่อไปนี้ ไฮโดรเจน (H) ออกเสียงเป็น ไฮไดรต์ คาร์บอน (C) ออกเสียงเป็น คาร์ไบด์ ไนโตรเจน (N) ออกเสียงเป็น ไนไตรด์ ฟลูออรีน (F) ออกเสียงเป็น ฟลูออไรด์ คลอรีน (CI) ออกเสียงเป็น คลอไรต์ ออกซิเจน (O) ออกเสียงเป็น ออกไซต์ แต่มีข้อยกเว้น คือ ไม่ต้องมีการระบุจำนวนอะตอมของธาตุที่อยู่ด้านหน้าในกรณีที่ธาตุที่อยู่ด้านหน้ามีอยู่เพียงอะตอมเดียว และไม่จำเป็นต้องมีการระบุจำนวนอะตอมของธาตุในกรณีที่ธาตุที่อยู่ด้านหน้าเป็นธาตุไฮโดรเจน ไม่ว่าจะมีกี่อะตอมก็ตาม ตัวอย่างการเรียกชื่อสารประกอบโคเวเลนต์ N2O5N เรียกว่า ไดโนโตรเจนเพนตะออกไซด์ N2O เรียกว่า ไดโนโตรเจนมอนอกไซด์CCI4 เรียกว่า คาร์บอนเตตระคลอไรด์SO2 เรียกว่า ซัลเฟอร์ไดออกไซด์ CO เรียกว่า คาร์บอนมอนนอกไซด์ CO2 เรียกว่า คาร์บอนไดออกไซด์ H2S เรียกว่า ไฮโดรเจนซัลไฟด์ความยาวและพลังงานพันธะของสารโคเวเลนต์ รูปร่างโมเลกุลโคเวเลนต์ สภาพขั้วของโมเลกุลโคเวเลนต์ พันธะโคเวเลนต์ไม่มีขั้ว ลักษณะสำคัญของพันธะโคเวเลนต์ไม่มีขั้ว 1.เป็นพันธะโคเวเลนต์ที่เกิดกับคู่อะตอมของธาตุชนิดเดียวกัน 2.เป็นพันธะโคเวเลนต์ที่มีการกระจายอิเล็กตรอนให้แต่ละอะตอมเท่ากัน 3.พันธะโคเวเลนต์ไม่มีขั้วอาจจะเกิดกับพันธะโคเวเลนต์ชนิดพันธะเดี่ยว เช่น Cl - Cl พันธะโคเวเลนต์ชนิดพันธะคู่ เช่น O = O และพันธะโคเวเลนต์ชนิดพันธะสาม เช่น N N 4.พันธะโคเวเลนต์ที่ไม่มีขั้วเกิดในโมเลกุลใดเรียกว่า โมเลกุลไม่มีขั้ว (non- polar molecule) พันธะโคเวเลนต์มีขั้ว ลักษณะสำคัญของพันธะโคเวเลนต์มีขั้ว 1.พันธะโคเวเลนต์มีขั้วเกิดกับคู่อะตอมของธาตุต่างชนิดกันที่มีค่าอิเล็กโทรเนกาติวิตีต่างกัน 2.เป็นพันธะโคเวเลนต์ที่มีการกระจายอิเล็กตรอนในแต่ละอะตอมไม่เท่ากัน 3.พันธะโคเวเลนต์มีขั้วเกิดในโมเลกุลใด โมเลกุลนั้นจะมีขั้วหรืออาจจะไม่มีขั้วก็ได้ แต่ถ้าพันธะโคเวเลนต์มีขั้ว เกิดในโมเลกุลที่มีเพียง 2 อะตอม โมเลกุลนั้นต้องเป็นโมเลกุลมีขั้วเสมอ เขียนสัญลักษณ์แสดงขั้วของพันธะ ใช้เครื่องหมาย อ่านว่า เดลตา โดยกำหนดให้ว่า พันธะมีขั้วใดที่อะตอมแสดงอำนาจไฟฟ้าลบ (เป็นอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูง) ใช้เครื่องหมายแทนด้วย และพันธะโคเวเลนต์มีขั้วใดที่อะตอมแสดงอำนาจไฟฟ้าบวก (เป็นอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่ำ ) ใช้เครื่องหมายแทนด้วย เช่น HF และ ClF แรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์ เมื่ออะตอมของธาตุต่าง ๆ มีการสร้างพันธะร่วมกันจนกลายเป็นโมเลกุลโคเวเลนต์แล้ว โมเลกุลจะมีแรงยึดเหนี่ยวระหว่างกันทำให้สามารถเข้ามาอยู่ร่วมกันเป็นกลุ่มก้อนของสารต่าง ๆ ได้ โดยแรงยึดเหนี่ยวระหว่างโมเลกุลนี้จะเป็นปัจจัยสำคัญที่มีอิทธิพลต่อสมบัติต่าง ๆ ของสาร เช่น สถานะของสาร จุดเดือดและจุดหลอมเหลว การนำไฟฟ้าของสาร เป็นต้น ในโมเลกุลโคเวเลนต์ต่าง ๆ ไม่ว่าจะเป็นโมเลกุลที่มีขั้วหรือไม่มีขั้ว ล้วนแต่มีแรงยึดเหนี่ยวระหว่างโมเลกุลด้วยกันทั้งสิ้น ซึ่งแรงยึดเหนี่ยวที่เกิดขึ้นระหว่างโมเลกุลโคเวเลนต์นั้นสามารถแบ่งได้เป็น 2 ประเภท ดังนี้ 1.แรงแวนเดอร์วาลส์ (Van der Waals Force) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุลของสาร ซึ่งประกอบด้วยแรง 2ชนิด คือ -แรงลอนดอน (London force หรือ Disperion force)เป็นแรงยึดเหนี่ยวที่เกิดขึ้นระหว่างโมเลกุลโคเวเลนต์ที่ไม่มีขั้ว มีแรงยึดเหนี่ยวต่ำเกิดจากอิเล็กตรอนคู่ร่วมพันธะที่อยู่ระหว่างอะตอมมีการเคลื่อนที่ไปรอบ ๆ อะตอมทำให้เกิดสภาพขั้วไฟฟ้าอ่อน ๆ ขึ้นชั่วขณะ จึงทำให้โมเลกุลของสารดึงดูดเข้าหากันได้ สารที่มีแรงยึดเหนี่ยวประเภทนี้จึงเป็นสารที่มีจุดเดือดและจุดหลอมเหลวต่ำ -แรงดึงดูดระหว่างขั้ว (Dipole-dipole force) เป็นแรงยึดเหนี่ยวที่เกิดระหว่างโมเลกุลโคเวเลนต์ที่มีขั้วเกิดจากขั้วบวกของโมเลกุลหนึ่งดึงดูดระหว่างขั้วนี้จะมีความแข็งแรงมากกว่าแรงลอนดอน ดังนั้นสารที่มีแรงยึดเหนี่ยวชนิดนี้จะมีจุดเดือดและจุดหลอมเหลวสูงกว่าสารที่ยึดเหนี่ยวกันด้วยแรงลอนดอน 2.พันธะไฮโดรเจน (Hydrogen bond) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุลที่มีลักษณะคล้ายกับแรงดึงดูดระหว่างขั้ว แต่จะเกิดขึ้นในโมเลกุลของสารประกอบที่เกิดจากอะตอมของธาตุไฮโดรเจน (H) ซึ่งสร้างพันธะกับอะตอมของธาตุฟลูออรีน (F) หรือออกซิเจน (O) หรือ ไนโตรเจน (N) เนื่องจากอะตอมของธาตุเหล่านี้มีความสามารถในการดึงดูดอิเล็กตรอนที่สูงกว่าอะตอมของไฮโดรเจนมาก ทำให้สามารถดึงดูดอิเล็กตรอนคู่ร่วมพันธะให้เบี่ยงเบนไปจากแนวกึ่งกลางได้มาก จึงเกิดสภาพขั้วที่รุนแรงกว่ามาก ทำให้พันธะไฮโดรเจนมีความแข็งแรงยากต่อการสลายพันธะ ตัวอย่างของสารประกอบที่มีแรงดึงดูดระหว่างโมเลกุลแบบพันธะไฮโดรเจน ได้แก่ น้ำ (H2O), แอมโมเนีย (NH3) เป็นต้น |
บทที่3.2
พันธะไอออนิก ( Ionic bond ) เป็นแรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2 อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก โลหะส่วนใหญ่มีค่าอิเล็กโตรเนกาติวิตีต่ำจึงเสียอิเล็กตรอนให้แก่อะตอมของอโลหะซึ่งมีค่าอิเล็กโตรเนกาติวิตีสูง และทำให้อิเล็กตรอนที่อยู่รอบ ๆ อะตอมครบ 8 ( octat rule ) โลหะกลายเป็นไอออนบวก และอโลหะกลายเป็นไอออนลบตามลำดับ เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ และเกิดเป็นโมเลกุลขึ้น โดยแรงดึงดูดจะแปรผันโดยตรงกับจำนวนประจุบวกและลบของไอออนทั้งสองที่ยึดติดกัน ดังนั้นค่าประจุยิ่งมาก แรงดึงดูดยิ่งมาก พันธะยิ่งแข็งแรง และแรงดึงดูดจะแปรผกผันกับระยะทางระหว่างไอออนทั้งสอง ไอออนบวกและไอออนลบอยู่ห่างกันมาก แรงดึงดูดจะน้อยลง
ลักษณะสำคัญของสารประกอบไอออนิก
1. พันธะไอออนิกเป็นพันธะที่เกิดจาก ไอออนของโลหะ + ไอออนของอโลหะ เช่น NaCl, MgO, KI
2. พันธะไอออนิก อาจเป็นพันธะเคมีที่เกิดจากธาตุที่มีค่าพลังงานไอออไนเซชันต่ำกับธาตุที่มีค่าพลังงานไอออไนเซชันสูง
3. พันธะไอออนิก อาจเป็นพันธะที่เกิดจากไอออบวกที่เป็นกลุ่มอะตอมของอโลหะ เช่น
6. สารประกอบไอออนิกในภาวะปกติเป็นของแข็ง ประกอบไอออนบวกและไอออนลบ ไอออนเหล่านี้ไม่เคลื่อนที่ ดังนั้นจึงไม่นำไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้ำ จะแตกตัวเป็นอิออนและเคลื่อที่ได้ เกิดเป็นสารอิเล็กโทรไลดต์จึงนำไฟฟ้าได้
ธาตุหมู่ | I | II | II | IV | V | VI | VII |
ประจุบนไอออน | +1 | +2 | +3 | -4 | -3 | -2 | -1 |
1. สารประกอบธาตุคู่ ถ้าสารประกอบเกิดจาก ธาตุโลหะที่มีไอออนได้ชนิดเดียวรวมกับอโลหะ ให้อ่านชื่อโลหะที่เป็นไอออนบวก แล้วตามด้วยชื่อธาตุอโลหะที่เป็นไอออนลบ โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น
-ออกซิเจน เปลี่ยนเป็น ออกไซด์ (oxide)
NaCl อ่านว่า โซเดียมคลอไรด์ (Sodium chloridr) | CaI2 อ่านว่า แคลเซียมไอโอไดด์ (Calcium iodide) |
KBr อ่านว่า โพแทสเซียมโบรไมด์ (Potascium bromide) | CaCl2 อ่านว่า แคลเซียมคลอไรด์ (Calcium chloride) |
FeCl2 อ่านว่า ไอร์ออน (II) คลอไรด์ ( Iron (II) chloride ) | CuS อ่านว่า คอปเปอร์ (I) ซัลไฟด์ ( Cupper (I) sunfide ) |
FeCl3 อ่านว่า ไอร์ออน (III) คลอไรด์ ( Iron (III) chloride ) | Cu2S อ่านว่า คอปเปอร์ (II) ซัลไฟด์ ( Copper (II) sunfide ) |
ตัวกับกลุ่มไอออนลบ ให้อ่านชื่อไอออนบวกของโลหะหรือชื่อกลุ่มไอออนบวก แล้วตามด้วยกลุ่มไอออนลบ เช่น
CaCO3 อ่านว่า แคลเซียมคาร์บอนเนต (Calcium carbonatX | KNO3 อ่านว่า โพแทสเซียมไนเตรต (Potascium nitrae) |
Ba(OH)2 อ่านว่า แบเรียมไฮดรอกไซด์ (Barium hydroxide) | (NH4)3PO4 อ่านว่า แอมโมเนียมฟอสเฟต (Ammomium pospate) |
ในการละลายน้ำของสารประกอบไอออนิก จะมีขั้นย่อยๆของการเปลี่ยนแปลง 2 ขั้นตอน ดังนี้
ขั้นที่ 1 ผลึกของสารประกอบไอออนิกสลายตัวออกเป็นไอออนบวกและลบในภาวะก๊าซ ขั้นนี้ต้องใช้พลังงานเพื่อสลายผลีก พลังงานนี้เรียกว่า พลังงานโครงร่างผลึก ( latece energy ) , E1
ขั้นที่ 2 ไอออนบวกและไอออนลบในภาวะก๊าซรวมตัวกับน้ำ ขั้นนี้มีการคายพลังงาน พลังงานที่คายออกมาเรียกว่า พลังงานไฮเดรชัน (Hydration energy ) , E2
พลังงานของการละลาย ( D E) มีค่า = E1 + E2 พลังงานของการละลายพิจารณาจากพลังงานโครงร่างผลึก ( E1 ) และพลังงานไฮเดรชัน( E2 ) ดังนี้
1.ถ้าค่า D E< 0 ( E1 < E2 ) การละลายจะเป็นแบบคายพลังงาน
2.ถ้าค่าD E > 0 ( E1 > E2 ) การละลายจะเป็นแบบดูดพลังงาน
3.ถ้าD E = 0 ( E1 = E2 ) การละลายจะไม่คายพลังงาน
4.ถ้า พลังงานโครงร่างผลึกมีค่ามากกว่าพลังงานไฮเดรชันมากๆ ( E1 >>>> E2 ) จะไม่ละลายน้ำ
บทที่3.1
สัญลักษณ์แบบจุดของลิวอิสและกฎออกเตต
หลักการเขียนโครงสร้างแบบจุด
4.ในกรณีที่ใช้เวเลนซ์อิเล็กตรอนจนหมดแล้ว แต่อะตอมมีอิเล็กตรอนไม่ครบ 8 ตัว นั้นหมายถึงว่า อาจมีพันธะคู่หรือพันธะสามเกิดขึ้น
-แสดงว่าธาตุเฉื่อยเป็นธาตุที่เสถียรมาก
-โดยการรวมตัวกันเป็นโมเลกุลหรือใช้อิเล็กตรอนร่วมกันเพื่อทำให้เวเลนต์อิเล็กตรอนเท่ากับ 8 ส่วนไฮโดรเจนจะพยายามปรับตัวให้มีเวเลนต์อิเล็กตรอนเท่ากับ2 เหมือนธาตุ He โดยการรวมตัวกันเป็นโมเลกุลหรือใช้อิเล็กตรอนร่วมกันเพื่อทำให้เวเลนต์อิเล็กตรอนเท่ากับ 8
ส่วนไฮโดรเจนจะพยายามปรับตัวให้มีเวเลนต์อิเล็กตรอนเท่ากับ2 เหมือนธาตุ He
ข้อยกเว้นสำหรับกฎออกเตต
ดังที่ได้กล่าวมาแล้วว่าอะตอมของธาตุต่าง ๆ มักจะรวมตัวกันเป็นสารประกอบเพื่อให้เป็นไปตามกฎออกเตต ซึ่งจะทำให้สารประกอบนั้นอยู่ในสภาพที่เสถียรเช่น H2O, PCl3, NH3, CO2 แต่อย่างไรก็ตามเมื่อมีการศึกษาให้กว้างขวางออกไป ก็พบว่าสารประกอบบางชนิดมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามกฎออกเตต บางชนิดมีเวเลนต์อิเล็กตรอนน้อยกว่า8 และบางชนิดมีเวเลนต์อิเล็กตรอนมากกว่า 8 ซึ่งสารต่างๆ เหล่านี้แม้ว่าจะไม่เป็นไปตามกฎออกเตต แต่ก็อยู่ในภาวะที่ไม่เสถึยร จัดว่าเป็นข้อยกเว้นสำหรับกฎออกเตต ซึ่งสรุปได้ดังนี้
5B = 2 , 3 เวเลนต์อิเล็กตรอนเท่ากับ 3
ธาตุ Be และ B เมื่อเกิดเป็นสารประกอบโคเวเลนต์ทั่ว ๆ ไปจะไม่ครบออกเตต
บทที่3.5
การใช้ประโชน์ของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ สมบัติบางประการของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ จากการที่สารประกอบไออ...

-
พั นธะโลหะ ( Metallic bonding) เป็นพันธะภายในโลหะซึ่งเกี่ยวข้องกับ การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่าง แลตทิซของอะตอมโลหะดังนั้น...
-
พันธะไอออนิก ( Ionic bond ) เป็นแรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2 อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก โลหะส่...
-
2.7.1ประโยชน์ของธาตุ การจำแนกธาตุออกเป็นกลุ่มนอกจากจะช่วยให้ง่ายต่อการศึกษาของธาตุแล้วยัง ง่ายต้อการพิจารณาสมบัติที่เหมาสมในการนำไปประยุกต์...