จากการศึกษาของนักวิทยาศาสตร์โดยอาศัยสมบัติที่เป็นคลื่นของอิเล็กตรอน และใช้ความรู้เกี่ยวกับกลศาสตร์ควอนตัม เพื่อนำไปอธิบายโคร้างสร้างอะตอม ทำให้ทราบว่าอิเล็กตรอนอยู่ในระดับพลังงานหรือวาง (shell) ต่างๆ กัน และในระดับพลังงานเดียวกันยังมีการแบ่งเป็นระดับพลังงานย่อย (sub shell) ต่างๆ ซึ่งกำหนดเป็นตัวอักษร s p d และ f ตามลำดับด้วย ตัวอย่างจำนวนระดับพลังงานย่อยที่เป็นไปได้ในแต่ละระดับพลังงานตั้งแต่ระดับพลังงานที่ 1 - 4 เป็นดังนี้
-ระดับพลังงานที่ 1 (n = 1) มี 1 ระดับพลังงานย่อยคือ s
-ระดับพลังงานที่ 2 (n = 2) มี 2 ระดับพลังงานย่อยคือ s p
-ระดับพลังงานที่ 3 (n = 3) มี 3 ระดับพลังงานย่อยคือ s p d
-ระดับพลังงานที่ 4 (n = 4) มี 4 ระดับพลังงานย่อยคือ s p d f
-ระดับพลังงานที่ 2 (n = 2) มี 2 ระดับพลังงานย่อยคือ s p
-ระดับพลังงานที่ 3 (n = 3) มี 3 ระดับพลังงานย่อยคือ s p d
-ระดับพลังงานที่ 4 (n = 4) มี 4 ระดับพลังงานย่อยคือ s p d f
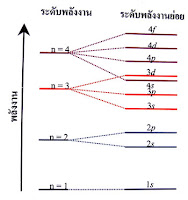
ในกรณีของอะตอมที่มีหลายอิเล็กตรอน ระดับพลังงานย่อยที่อยู่ในระดับพลังงานเดียวกันจะมีพลังงานแตกต่างกันดังแสดงในรูป 1.19 และในแต่ละระดับพลังงานย่อยจะมีจำนวนออร์บิทัลแตกต่างกันดังนี้
-ระดับพลังงานย่อย s มี 1 ออร์บิลทัล
-ระดับพลังงานย่อย p มี 3 ออร์บิลทัล
-ระดับพลังงานย่อย d มี 5 ออร์บิลทัล
-ระดับพลังงานย่อย f มี 7 ออร์บิลทัล
-ระดับพลังงานย่อย s มี 1 ออร์บิลทัล
-ระดับพลังงานย่อย p มี 3 ออร์บิลทัล
-ระดับพลังงานย่อย d มี 5 ออร์บิลทัล
-ระดับพลังงานย่อย f มี 7 ออร์บิลทัล
หลักการบรรจุอิเล็กตรอน
1.หลักของเพาลี (Pauli exclusion principle) กล่าวว่า “ไม่มีอิเล็กตรอนคู่หนึ่งคู่ใดในอะตอมที่มีเลขควอนตัมทั้งสี่เหมือนกันทุกประการ” นั่นคืออิเล็กตรอนคู่หนึ่งในออร์บิทัลจะมีค่า n, ℓ, mℓ เหมือนกันได้ แต่ต่างกันที่สปิน
2.หลักของเอาฟ์บาว (Aufbau principle) มีวิธีการดังนี้
2.หลักของเอาฟ์บาว (Aufbau principle) มีวิธีการดังนี้
2.1. สัญลักษณ์วงกลม O หรือ _ แทน ออร์บิทัล
ลูกศร ↑↓ แทน อิเล็กตรอน 1 ตัว ที่สปิน ขึ้น-ลง ↑↓ เรียกว่า อิเล็กตรอนคู่ (paired electron)
2.2. บรรจุอิเล็กตรอนเข้าไปในออร์บิทัลที่มีระดับพลังงานต่ำจนครบจำนวนก่อน
ลูกศร ↑↓ แทน อิเล็กตรอน 1 ตัว ที่สปิน ขึ้น-ลง ↑↓ เรียกว่า อิเล็กตรอนคู่ (paired electron)
2.2. บรรจุอิเล็กตรอนเข้าไปในออร์บิทัลที่มีระดับพลังงานต่ำจนครบจำนวนก่อน
3.กฎของฮุนด์ (Hund’s rule) กล่าวว่า “การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน (degenerate orbital) จะบรรจุในลักษณะที่ท้าให้มีอิเล็กตรอนเดี่ยวมากที่สุดเท่าที่จะมากได้” ออร์บิทัลที่มีระดับพลังงานมากกว่า 1 เช่น ออรฺบิทัล p และ d เป็นต้น
4.การบรรจุเต็ม (filled configuration) เป็นการบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน แบบเต็ม ครบ 2 ตัว ส่วนการบรรจุครึ่ง (half- filled configuration) เป็นการบรรจุอิเล็กตรอนลงในออร์บิทัลแบบครึ่งหรือเพียง 1 ตัว เท่านั้น ซึ่งการบรรจุทั้งสองแบบ (ของเวเลนซ์อิเล็กตรอน) จะทำให้มีความเสถียรมากกว่าตัวอย่างการบรรจุเต็ม







No comments:
Post a Comment